Гипофизарные инъекции в рыбоводстве (обзор подготовлен Мироновым С. Г.)
Физиологический метод или метод гипофизарных инъекций - применяется для большинства весеннее-летне нерестующих рыб (осетр, карп, лещ, судак, белый амур и др.). К применению метода гипофизарных инъекций в рыбоводстве независимо друг от друга пришли два исследователя: Иеринг (Ihering) в Бразилии - 1935 г. и Гербильский в СССР - 1936 г. /Гербильский, 1975/.
Для стимуляции созревания производителей рыб используется тот же гонадотропный гормон, который содержится в гипофизе, и при нересте в естественных условиях поступает из гипофиза в кровь, вызывая созревание половых клеток. Гонадотропный гормон может накапливается в гипофизе рыб в определенные сезоны года (перед нерестом). Это позволяет использовать гипофиз рыб-доноров как источник гонадотропного гормона, при помощи которого можно получать зрелые половые продукты от производителей на рыбоводных предприятиях /Иванов, 1988/.
При внутримышечных инъекциях суспензии гипофиза рыб производителям, гонадотропный гормон поступает в кровь и стимулирует у них переход половых желез от IV к V стадии зрелости, получение зрелой, способной к оплодотворению икры у самок и доброкачественной спермы у самцов. При такой искусственной стимуляции созревания производителей путем введения им гипофизов, взятых от других рыб, происходит увеличение количества гонадотропного гормона гипофиза в крови. В природной среде то же самое происходит под влиянием нерестовых условий, усиливающих выделение собственного гонадотропного гормона /Иванов, 1988/. Для того, чтобы обеспечить длительность хранения гипофизов, извлеченных у рыб-доноров, их подвергают обработке химически чистым ацетоном, который обезвоживает и обезжиривает ткань гипофиза.
В ряде случаев гонадотропный гормон обладает видовой специфичностью, т. е. гипофиз, взятый у рыб одного вида, может оказаться неэффективным для других видов рыб. Например, гипофизы судака не подходят для стимуляции созревания у карповых рыб, поэтому на рыбоводных предприятиях для стимуляции созревания производителей используют, как правило, гипофизы того же вида рыбы. Гипофизы заготавливают только у рыб находящихся на IV стадии зрелости. Наилучшее время заготовки гипофизов - преднерестовая миграция. Для того чтобы подготовить гипофизы для хранения, их после извлечения подвергают ацетонированию.
Количество вводимого гипофиза зависит от его гонадотропной активности. Гонадотропная активность гипофиза определяется с помощью тест-объектов, в качестве которых используют самок вьюна или самцов лягушек. Вьюновая единица (В.Е.) - это такая минимальная доза гипофиза, которая у зимней самки вьюна, находящейся на IV стадии зрелости, средней массой 35 - 45 г вызывает созревание и овуляцию икры через 30 - 50 часов после инъекции при температуре 16 - 18 0С в лабораторных условиях. Лягушачья единица (Л. Е.) - это такая минимальная доза гипофиза, которая через 30 - 40 мин после инъекции вызывает реакцию спермиации у одного самца лягушки. Наилучшее время тестирования активности гипофизов - март. Активность 1 мг препарата ацетонированного гипофиза сазана обычно соответствует 1 Л. Е., 1 мг ацетонированного гипофиза осетра соответствует обычно 3,3 Л. Е. /Иванов, 1988/.
При проведении гипофизарных инъекций доза вводимого препарата, количество инъекций и продолжительность созревания производителей во многом зависят от температуры воды и степени зрелости производителей.
Следует учитывать, что при гипофизарных инъекциях положительного результата можно добиться только в том случае, если гонады инъецируемой рыбы находятся в IV завершенной стадии зрелости. Если гонады у производителей имеют более низкую стадию зрелости, то гипофизарная инъекция не вызывает у них созревания половых продуктов, либо половые продукты оказываются непригодными к оплодотворению. Завершенность IV стадии зрелости гонад у самок может быть оценена по степени поляризации ядра в ооците, что выявляется с помощью биопсии. У недостаточно зрелой икры ядро располагается в центре и по мере созревания перемещается к анимальному полюсу. Оценка степени зрелости гонад у самок по поляризации ядра чаще всего проводится для карпа и осетровых рыб. При этом самок осетровых рыб можно инъецировать только при достижении определенной степени поляризации ядра в ооците.
Дозы гонадотропных гормонов для стимуляции созревания различных видов рыб приведены в таблице.
Дозы гонадотропного гормона гипофиза, применяемого для стимуляции созревания производителей разных видов рыб
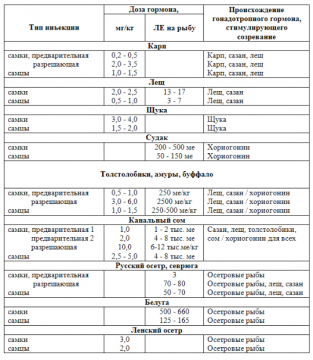
Примечание:
ме - мышиные единицы - для хориогонина.
При гормональной стимуляции созревания производителей гипофизарные инъекции самкам производятся, как правило, дробно: общее количество гипофиза, необходимое для созревания икры, делится на несколько порций - одну или две предварительных и разрешающую инъекции. Такая схема в особенности подходит для стимуляции созревания самок карпа, если ядро у них находится в центре ооцита. Предварительная инъекция составляет обычно 1/10 часть общей дозы. При низких температурах воды (в пределах нерестового диапазона температур) количество инъекций также может быть увеличено до трех и более (применяется для карпа). Промежуток времени между инъекциями может составлять от 6 до 12 часов в зависимости от температуры. Например, для стимуляции развития ооцитов у карпа, если ядра находятся в центре, применяется трехкратные гипофизарные инъекции, при которых первая доза составляет 0,2 мг/кг, вторая - через 6 часов - 0,4 мг/кг, третья - через 12 часов после второй - 2 мг/кг. При отсутствии овуляции икры после третьей инъекции стимуляцию продолжают, при этом доза каждой последующей инъекции увеличивается на 0,25 - 0,5 мг/кг, четвертая и последующие инъекции делаются через 24 часа.
Самцы хорошо созревают после однократной гипофизарной инъекции, поэтому, например, самцам карпа вводится доза гипофизов в два раза меньшая, чем самкам. Самцов инъецируют, как правило, за час до разрешающей инъекции самкам.
Общее количество гипофиза, требуемого для стимуляции, рассчитывается исходя из общей массы производителей, с учетом температуры воды (у верхней границы нерестового диапазона доза снижается). При приготовлении суспензии гипофизов для инъецирования их взвешивают, измельчают, помещают в фарфоровую ступку и тщательно растирают пестиком до порошкообразного состояния. Затем, помешивая, постепенно добавляют необходимое количество физиологического раствора, исходя из нормы 0,5 или 1 мл на одного производителя. Суспензия гипофизов медленно вводится в мышцы спины выше боковой линии в первую треть тела рыбы (карпу - под чешуйку). Место прокола при этом придерживается пальцем, и после удаления иглы несколько секунд массируется, чтобы введенная суспензия не вылилась обратно.
Для обеспечения нормального созревания икры после гипофизарной инъекции температуру воды в емкостях с производителями постепенно увеличивают на 2 - 3 оC. После проведения инъекций недопустимо понижение температуры.
Гипофизы, используемые для инъекций наряду с гонадотропным гормоном, содержат и тиреотропный гормон, повышающий уровень обменных процессов у рыбы, поэтому у инъецированных рыб возрастает потребность в кислороде. Содержание кислорода в воде должно быть оптимальным.
Ссылки на источники:
Гербильский Н.Л. Метод гипофизарных инъекций и его роль в рыбоводстве // Гормональная стимуляция полового цикла рыб в связи с задачами воспроизводства рыбных запасов: Труды ВНИРО. – Т. 111. – Л.: Наука, 1975. С. 7 – 22.
Иванов А.П. Рыбоводство в естественных водоемах. – М.: Агропромиздат, 1988. – 367 с.


















